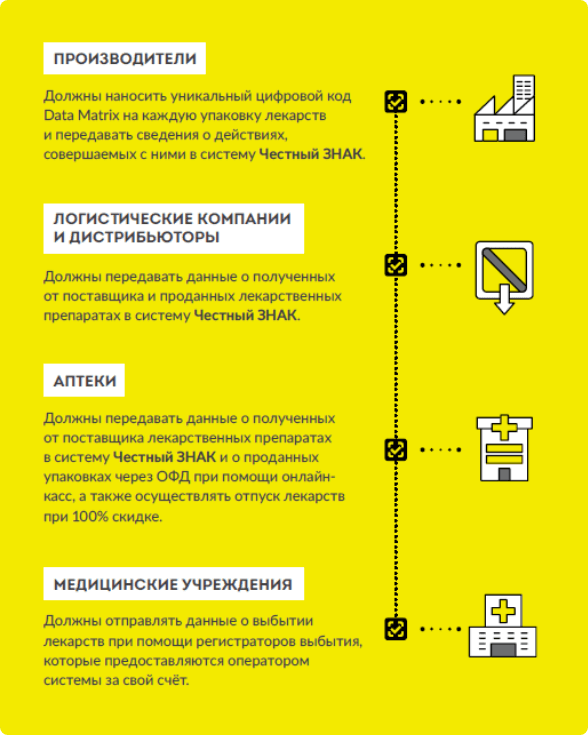
Таким образом, государство получает возможность:
- отслеживать и изымать поддельную продукцию на любом из этапов ее обращения;
- препятствовать незаконной реализации ЛП, не зарегистрированных в системе мониторинга движения лекарственных препаратов;
- контролировать движение лекарственных препаратов, закупаемых за счет бюджета;
- планировать необходимые запасы ЛП и управлять ими с помощью данных новой системы, чтобы не было их дефицита на рынке;
- контролировать необоснованный рост цен на лекарственные препараты, относящихся к ЖНВЛП.
Владельцам бизнеса в сфере фарминдустрии и реализации лекарственных препаратов новая система позволит минимизировать издержки за счет оптимизации организационно-управленческих и производственно-технологических процессов, а также обеспечить поставку качественной продукции на фармацевтические рынки.
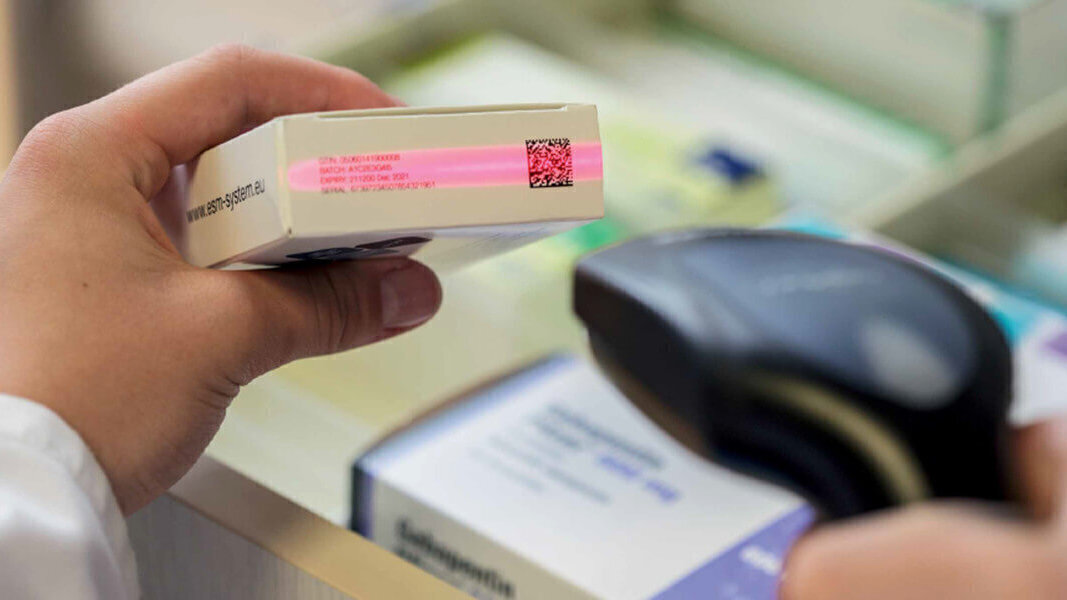
Маркировка лекарств включает в себя выполнение нескольких пунктов:
- Обязательная регистрация в системе Честный ЗНАК.
- Нанесение DataMatrix кода на упаковку лекарственных средств.
- Передачу прав на товары между юридическими лицами с указанием уникальных кодов лекарственных препаратов.
- Сканирование каждого идентификационного кода на кассе аптечной организации при продаже конечному покупателю.
Краткий экскурс в историю внедрения
Пунктом 5 Перечня поручений Президента по итогам совещания с членами Правительства РФ от 04.02.2015 дано поручение обеспечить разработку и поэтапное внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки и идентификации упаковок медикаментов. Однако, такие масштабные преобразования требовали немало ресурсов для их реализации, поэтому осуществлялись поэтапно:- С 1 февраля 2017 года система маркировки наконец-то введена, но в рамках эксперимента с участием крупных производителей, зарубежных поставщиков и аптек.
- С 1 июля 2019 года и до недавнего времени нововведения касались только препаратов, необходимых для лечения заболеваний из списка высокозатратных нозологий: гемофилии, муковисцидоза, рассеянного склероза, злокачественных опухолей, отторжения органов после трансплантации, миелолейкоза, гипофизарного нанизма, болезни Гоше, мукополисахаридоза, юношеского артрита и гемолитико-уремического синдрома. Продажу таких лекарственных препаратов без маркировки окончательно запретили 1 октября 2019 года.
- С 1 января по 29 февраля 2020 года все производители, дистрибьюторы, поставщики и продавцы любых лекарственных средств обязаны пройти регистрацию в системе Честный ЗНАК.
- С 1 июля 2020 года маркировка всех лекарств становится обязательной. Участники рынка передают в систему мониторинга данные об операциях с препаратами. Однако, позже был разрешен оборот немаркированных лекарственных препаратов, произведенных до октября 2020 года, пока не истечет их срок годности.
Проблемы и трудности реализации системы маркировки лекарств
Маркировка лекарственных препаратов имеет множество преимуществ. Однако, на практике оказалось, что рынок не готов к быстрому внедрению инноваций. Возникает множество проблем, требующих адекватного решения и внесения корректив в запланированные сроки нововведений:- Недостаточное техническое оснащение аптек. Для отпуска лекарств требуется специальное оборудование, способное сканировать DataMatrix код с упаковки препарата. К сожалению, не у всех точек продажи медикаментов, есть финансовая возможность закупить его.
- Увеличение стоимости лекарственных препаратов. Понесенные затраты на установку оборудования владельцы бизнеса постараются возместить за счет повышения цен на товары.
- «Зависания» и технические сбои системы. Подавать сведения в Честный ЗНАК обязан каждый участник оборота медикаментов, а производить дальнейшие операции с препаратами можно только после получения ответа. Последний может приходить с задержкой, что временно «парализует» отпуск лекарств из аптек. В условиях повышенного спроса на противовирусные и антибактериальные средства было принято решение о переходе на уведомительный режим маркировки, который поможет справиться со сложившимся дефицитом лекарственных препаратов. Свою роль сыграли и крупные технические сбои в системе маркировки лекарств 30 сентября и 20 октября 2020 года. В результате данные об уже загруженных в систему лекарствах были утрачены. Позже их удалось восстановить, но аптеки на время обновления системы столкнулись с проблемой реализации имеющихся препаратов и невозможностью оказать своевременную лекарственную помощь для сохранения жизни и здоровья граждан РФ.
- Перебои с поставками лекарств от зарубежных производителей. Ранее часть медикаментов «застревала» на таможенных складах. Это коснулось немаркированных импортируемых препаратов, не введенных в гражданский оборот до 1 июля 2020 года. Да и ввоз лекарств, имеющих идентификационный код, теперь осуществляется медленнее. Проблема в настоящее время решается благодаря введению уведомительного режима. Снижение регистрационных цен на дорогостоящие лекарственные препараты из списка ЖНВЛП, особенно на фоне роста их себестоимости вследствие ряда факторов, к которым относится и маркировка, в перспективе может привести к отказу от поставок инновационных препаратов, в том числе не производимых в нашей стране.
Учитывая масштаб страны необходимо принять во внимание количество участников рынка производителей – дистрибьюторов - аптечные организации и количества упаковок ЛП которые необходимо зафиксировать в системе МДЛП на всех этапах движения по товаро-проводящей цепи.
Уведомительный режим маркировки лекарств
Согласно утвержденному Минпромторгом 24 октября 2020 года уведомительному режиму, участник имеет право производить дальнейшие манипуляции с реализуемым товаром даже в отсутствии ответа от оператора по прошествии 15 минут. Ранее аптечные сети жаловались на сложности выполнения требований по маркировке препаратов: при поступлении их в аптеку требовалось регистрировать каждую упаковку в системе, на что уходило до 10 суток.Председатель Правительства РФ Михаил Мишустин 2 ноября 2020 года подписал постановление, упрощающее работу в системе. Согласно ему с 1 сентября 2020 года и до 1 июля 2021 года в РФ разрешается оборот немаркированнных препаратов, зарегистрированных согласно международным договорам и снабженных кодом ЕАЭС. За правилами их ввоза в страну будет наблюдать межведомственная комиссия. При обороте участники не обязаны дожидаться от поставщиков подтверждения приёмки препаратов, а импортёры, в свою очередь, могут не ждать от держателей или владельцев регистрационного удостоверения на препараты подтверждения ввоза. Эти сведения будут автоматически фиксироваться самой системой путём проверки кода товара и данных участника.
Уведомительный режим исключает создание «пробок» и ускоряет движение препаратов, что особенно актуально в условиях нынешней эпидемиологической обстановки. Изменения касаются всех лекарств, за исключением медикаментов из категории высокозатратных нозологий.